2パラメーター, 二変量ヒストグラム
(Two-parameter or bivariate histograms)
[English version]
これらのグラフは、X軸とY軸にそれぞれ異なる測定パラメーターをとり、イベントを密度(またはドット)プロットとして表示します。 パラメーターは、表示する内容に応じて蛍光、FSCまたはSSCにすることができます。 図16では、前方および側方散乱によって決定されたリンパ球(図16A)をCD3およびCD19で染色し、TおよびB細胞集団を同定しています。 その後、B細胞およびT細胞の相対的な割合を、異なる集団の周囲にゲートまたは4分割線(Quadrants)を設定することで定量化しています(図16B、C)。
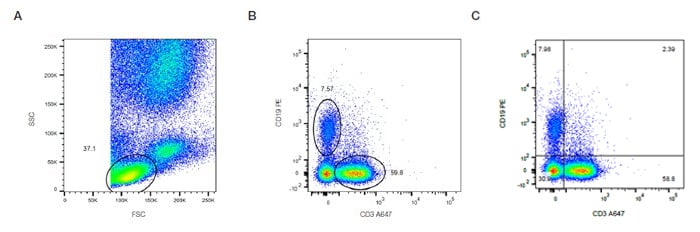
図16に示した実験の場合、7.5%のB細胞および59.8%のT細胞が存在します(図16B)。 このデータは、密度プロットを4象限に分割することでも視覚化でき、各マーカーに対して1つの単独陽性(Single Positive)および、二重陰性(Double Negative)と二重陽性(Double Positive)を判定することができます(図16C)。 発現レベルが明確な集団とならない場合や、相互に排他的でない場合、適切なコントロールは、陽性および陰性の集団を決定するのに役立ちます。
ゲーティング(Gating)
ゲーティングは、目的とする細胞集団を絞り込むために、データセット上で複数回使用する強力なフローサイトメトリーツールです。 単純なシーケンシャルゲーティングを繰り返し適用して、特定の細胞型の発現パターンを決定することができます。 これは、一回の実験で得られるマーカーや蛍光色素の数が増加するにつれ、特に有用です。 現在、フローサイトメトリーでは、17以上の蛍光マーカーで同時標識されたサンプルを分析することができますが、バイオ・ラッドのZE5™ Cell Analyzerなどの最大27色を検出することができるサイトメーターが利用可能です。 したがって、単一の実験では、解析のために大きなデータセットが得られます。 例えば、17色のパネルでは、二変量プロットが136個生成されます。
シーケンシャルゲーティングの例(Sequential Gating Example)
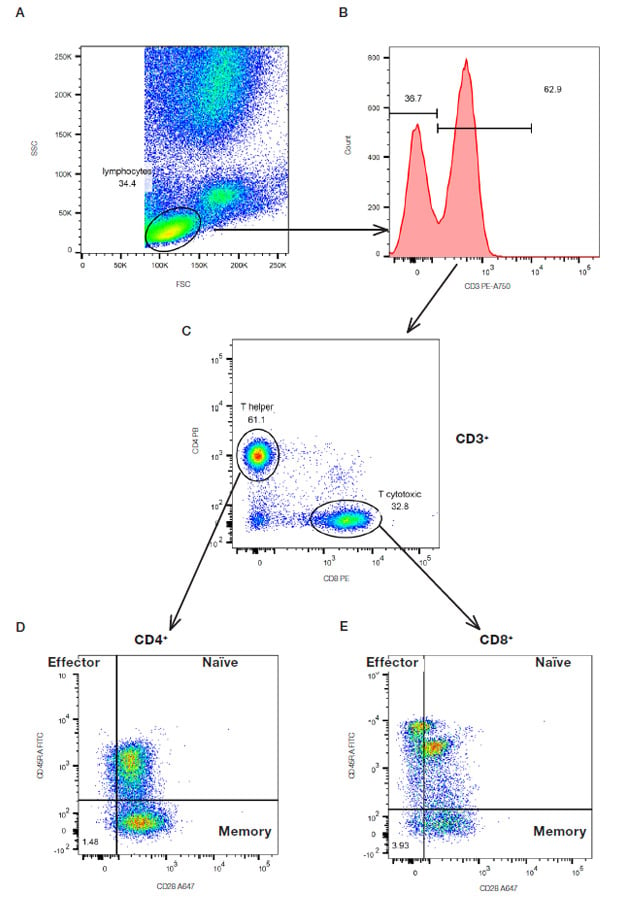
特定の細胞集団を同定するために単純なシーケンシャルゲーティングが使用されているマルチカラー実験の例を図17に示します。まず、リンパ球を前方散乱および側方散乱によって同定し、ゲーティングします(図17A)。 次いで、CD3陽性のT細胞を同定し(図17B)、さらにCD4およびCD8の発現でゲーティングします(図17C)。 CD45RA CD28ナイーブ細胞、CD45RA-CD28+メモリーT細胞およびCD45RA+ CD28-エフェクターT細胞を同定するためのCD28およびCD45RAの相対的発現量を、CD4+およびCD8+集団の両方で決定しました(図17DおよびE)。 このような原理で、さらにマーカーを追加して続けることができますが、細胞集団がより詳細になるにつれて、各ゲート内にイベントが少なくなるため、実験目的に対して十分な数の細胞を収集することが重要です。
- Flow Cytometry - Basics Guide
- 第3章 - データ解析
- ゲートとリージョン(Gates and regions)
- シングルパラメーター, 単変量ヒストグラム(Single-parameter or univariate histograms)
- 2パラメーター, 二変量ヒストグラム(Two-parameter or bivariate histograms)
- バックゲーティングによるゲート戦略の確認(Backgating to Confirm Gating Strategies)